物質の分解とはどういう変化?実験例や方法・注意点まで解説【中2理科|高校入試】

理科の化学分野で習う化学変化は実験や使う物質の名前も多く、苦手に感じる人も多いのではないでしょうか。化学変化は今後の学習の基礎になる部分。ここが理解できていないと、先の学習でもつまずいてしまうことも。1つ1つは難しくありません。重要なポイントをおさえながら覚えていくようにしましょう。
また、実験方法や注意点はテストで問われることがあります。理由なども一緒に記述できるようにしておきましょう。
目次
物質の分解とは
分解、というと1つのものがバラバラになるイメージがありますね。
理科の化学変化の1つである分解は、「1つの物質が、性質の異なる2つ以上の物質に分かれること」を指します。“性質の異なる”がポイントです。分解前の物質と、分解後に出てきた物質は性質が異なる、ということをおさえておきましょう。
また、分解前後の変化については、下のようにあらわすことができます。
分解前の物質→分解後の物質A+分解後の物質B+・・・
物質の分解の種類
物質の分解にはいくつかの種類があります。中学生では「熱分解」「電気分解」を主に扱いますが、「光分解」などもあります。
熱分解
熱を加えることで起こる分解。
例)炭酸水素ナトリウム、酸化銀
電気分解
電気を加えることで起こる分解。
例)水(水酸化ナトリウム水溶液)、塩化銅水溶液
物質の分解の実験例
熱分解
炭酸水素ナトリウムの熱分解
炭酸水素ナトリウムは熱によって分解されます。
最初に炭酸水素ナトリウムの性質について確認しましょう。
| 水への溶けやすさ | 水溶液の性質 | フェノールフタレイン液の反応 | |
|---|---|---|---|
| 炭酸水素ナトリウム | 少し溶ける | 弱いアルカリ性 | 薄い赤色 |
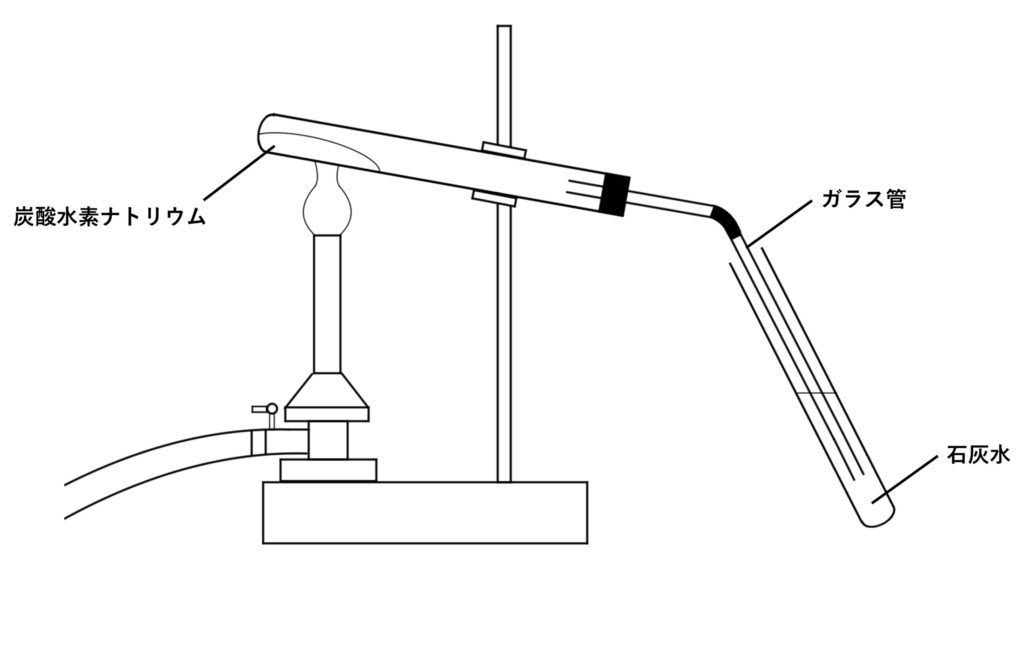
図のように試験管内の炭酸水素ナトリウムを加熱すると、気体が発生します。また、試験管の口付近には水滴がつきます。試験管内には白い粉末が残ります。
分解が起こった後の物質をそれぞれ調べてみましょう。
【発生した気体】
石灰水に通すと白く濁る➡二酸化炭素だとわかる
【試験管口付近の水滴】
青色塩化コバルト紙につけると赤色に変化する➡水だとわかる
【残った白い粉末】
水にはよく溶け、フェノールフタレイン液を加えると濃い赤色になった➡炭酸ナトリウムである
これらのことから、炭酸水素ナトリウムに熱を加えると、二酸化炭素・水・炭酸ナトリウムに分解されることが分かりました。
炭酸水素ナトリウム→炭酸ナトリウム+二酸化炭素+水
化学反応式ではこのように表します。
2NaHCO3→Na2CO3 + CO2 + H2O
実験の注意点
- 試験管の口付近には水が発生するため、加熱部分に流れ込まないように口のほうを少し下げておく。
- 石灰水が逆流するのを防ぐため、火を止める前に、気体を集めていた試験管からガラス管を抜く。
酸化銀の熱分解
酸化銀は黒色の物質です。「銀」とつきますが、金属の性質は持ちません。
下の図のような装置で加熱します。
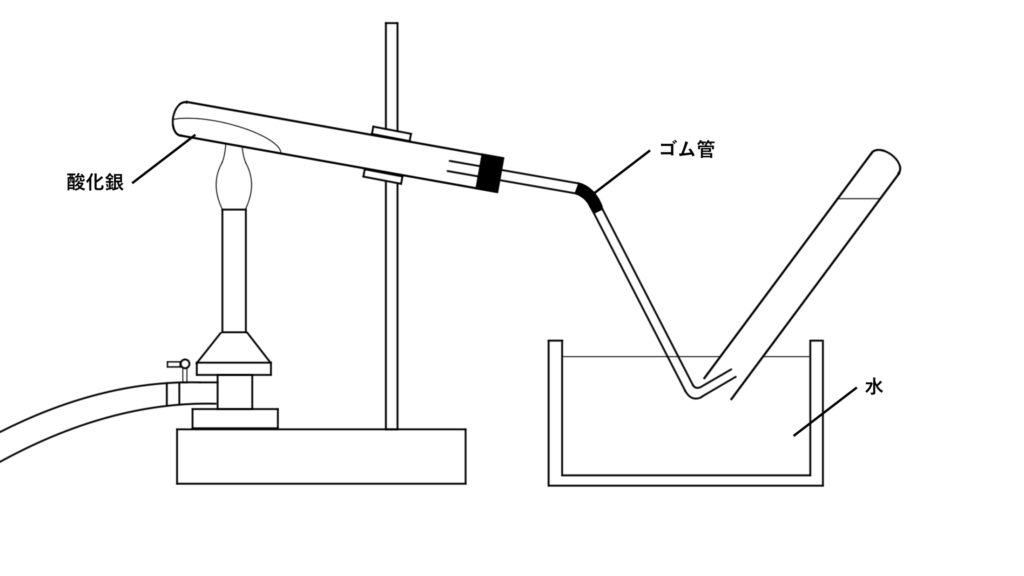
酸化銀を加熱していくと、気体が発生します。また、試験管内には白色の物質が残ります。
分解後の物質についてみていきましょう。
【発生した気体】
火のついた線香を近づけると激しく燃える➡酸素だとわかる
※酸素は水に溶けにくいため、水上置換法で集めます。
【残った白色の物質】
磨くと光るなど、金属の特徴を持つ➡銀である
これらのことから、酸化銀は熱で銀と酸素に分解されたことが分かりました。
酸化銀→銀+酸素
化学反応式ではこのように表します。
2Ag2O→4Ag + O2
実験の注意点
- 水や空気が逆流するのを防ぐため、火を止める前に、ゴム管をピンチコックで閉じる。
電気分解
水の電気分解
身近な物質である水は、電気を通すことによって分解することができます。ただし、純粋な水は電気を通しにくいため、水酸化ナトリウムを少量加え、電気を通しやすくします。
下の図のような装置を使って実験をします。
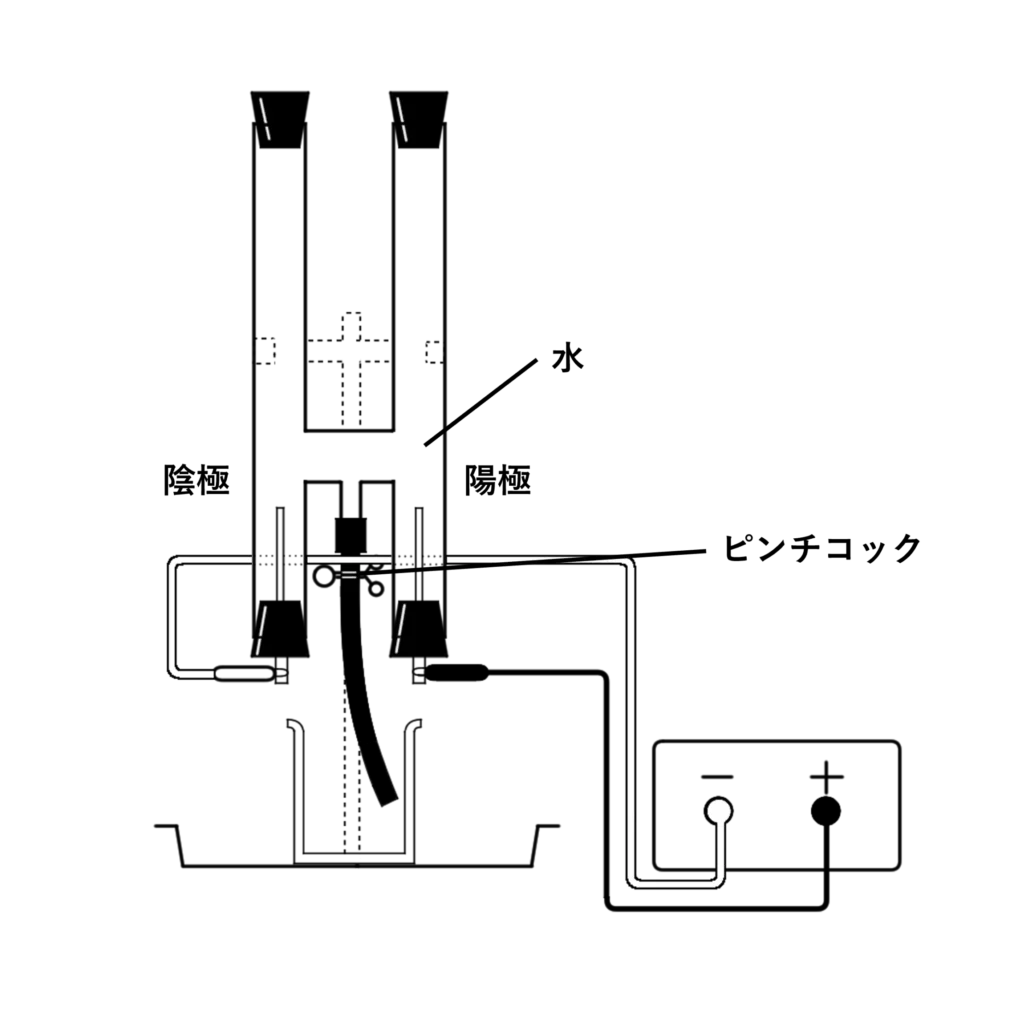
水に電気を通すと、陽極(プラスにつなげている方)、陰極(マイナスにつなげている方)両方から気体が発生します。
気体の体積量は陰極側:陽極側=2:1になります。
発生した2つの気体についてみていきましょう。
【陰極から発生した気体】
マッチの火を近づけると、音を立てて燃える➡水素だとわかる
【陽極から発生した気体】
火のついた線香を近づけると、激しく燃える➡酸素だとわかる
これらのことから、水に電気を通すと水素と酸素に分解されることが分かりました。
水→水素+酸素
化学反応式ではこのように表します。
2H2O→2H2+O2
水素と酸素の体積比は2:1になるので覚えておきましょう。
実験の注意点
- 気体が発生しゴム栓が飛ぶことを防ぐため、電気を通す時はピンチコックを開け、水が少しずつ落ちるようにしておく。
- 水酸化ナトリウムは分解前後で変化しないため、量は変わらない。そのため水酸化ナトリウム水溶液としての濃度は高くなる。
塩化銅水溶液の電気分解
塩化銅水溶液は青色をした液体です。下の図のような装置で実験をします。
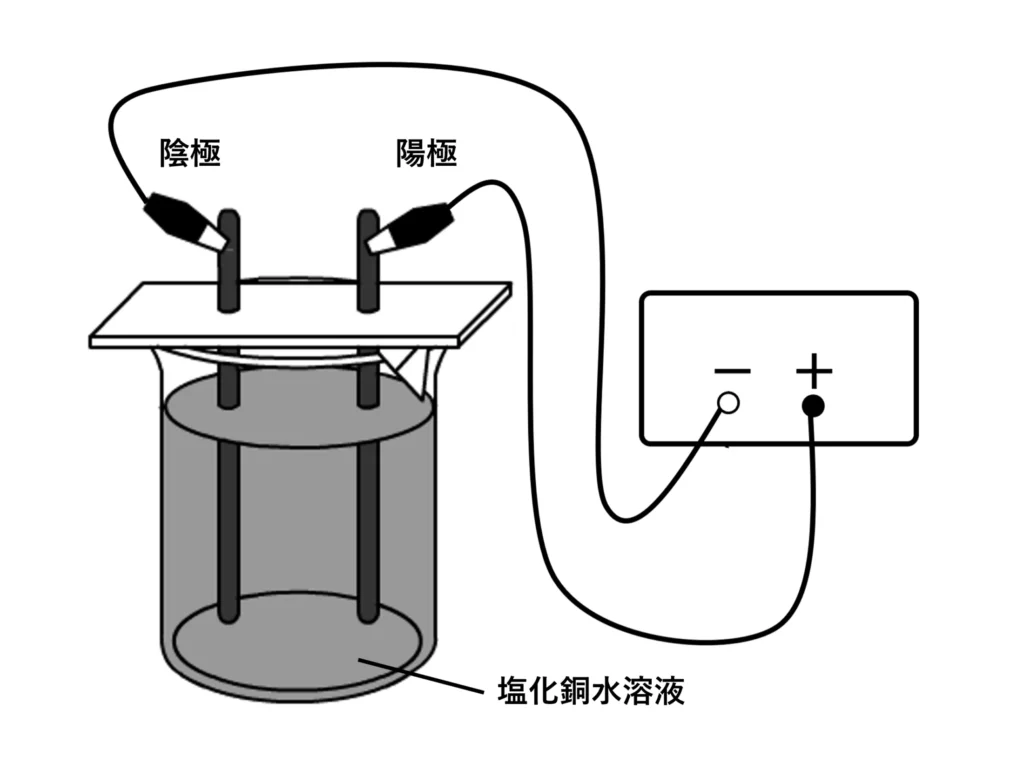
塩化銅水溶液に電気を通していくと、青色が薄くなっていき、陰極には赤色の物質が付着し、陽極からは気体が発生します。
それぞれについてみていきましょう。
【赤色の物質】
磨くと光るなど、金属の性質を持つ➡銅だとわかる
【気体】
刺激臭がする。また、陽極付近の液を薄めたインク液に加えると色が消えた(脱色)➡塩素だとわかる
これらのことから、塩化銅水溶液に電気を流すと塩化銅が銅と塩素に分解されることが分かりました。
塩化銅→銅+塩素
化学反応式ではこのように表します。
CuCl2→Cu+Cl2
分解は実験を思い浮かべながら覚えていこう!
分解だけではないですが、化学分野では実験内容がテストに出ることも多いです。物質名だけで覚えるのではなく、実験の流れなども含めて覚えていきましょう。そうすることで、丸暗記ではなくなり、つながりを持つ記憶になっていきます。学校などですべての実験を体験することは難しいかもしれませんが、今は動画サイトなどでも実験の様子が公開されています。イメージがつきにくいものは動画をみてみることも1つの手ですよ。
理科が苦手、計算問題が解けない、入試問題の複雑な問題になると手が止まる、などお困りの方はぜひ栄光にご相談ください。

栄光の高校受験対策では都道府県によって異なる高校入試の制度や出題傾向、最新の受験情報をもとに、進路指導を行ったうえで目標達成に必要な学習プランを作成し、苦手対策、定期テスト対策、志望校対策も、講師が生徒1人ひとりに寄り添って指導します。少人数で発言や質問がしやすく、仲間と切磋琢磨しながら成長できるグループ指導と、先生と隣り合わせでわからないところや苦手を中心に、自分のペースで学習を進められる個別指導があります。自分に合った指導形態で合格に向かって効率よく学習を進めることができます。家庭学習指導にも力を入れており、志望校合格に必要な学習内容をご提案。また、模試の結果を細かく分析したうえで苦手分野を徹底的に対策することで成績向上につなげます。








はじめての方はご希望の教科を
無料で体験できます











全教室の資料をメールで即お届け!
今すぐご検討いただけます。








